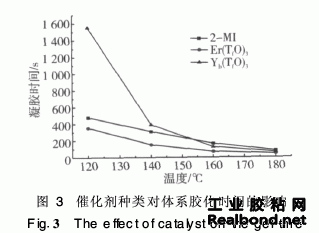
2·4 固化动力学研究
热固性材料固化反应是放热反应,固化反应程度正比于反应热,可用示差扫描量热来研究热固性树脂的固化动力学。
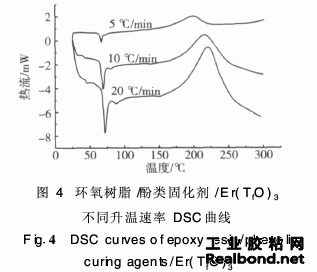
对环氧树脂/酚类固化剂/三氟甲磺酸铒体系(质量比100∶9∶1),采用不同的升温速率,在N2气氛下,进行DSC分析,结果见图4。由图4可见,环氧树脂/酚类固化剂体系的固化峰为单一峰。随着升温速率的提高,Ti、Tp、Tf都向高温方向移动,这是因为升温速率增大,则dH/dt增大即单位时间内产生的热效应越大,产生的温度差就越大,固化反应的放热峰就相应地向高温移动。
根据放热峰温随升温速率的变化进行分析计算表观活化能。在放热峰时的反应程度αp是恒定的,与升温速率无关。根据这一结论,以Ozawa方法直接可引出式1[6]:
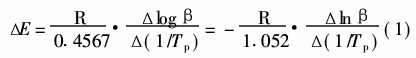
式中,β-等速升温速度(℃/min);Tp-峰 顶温度(K);R-理想气体常数8·3145 J/(mol·K); △E-表观活化能J/mol。
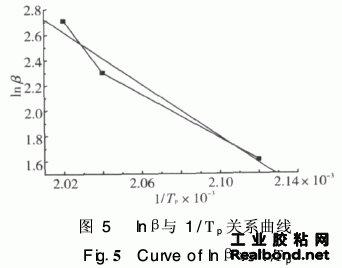
以lnβ对1/Tp作图(见图5),根据直线斜率 可求得其表观活化能ΔE=81·56 kJ/mol。
根据Kissinger通式,环氧树脂的固化反应公 式如式2所示[7]。
sayyes]http://www.curings.com/img/200998114764.gif>
式中,β-等速升温速度(℃/min);Tp-峰顶 温度(K); R-理想气体常数8·3145 J/(mol·K); E-表观活化能J/mol·K;A-表观反应频率因子。 根据体系不同升温速率下的固化反应DSC结 果计算-ln(β/T2)值,按Kissinger方程的-ln(β/T2)对1/Tp作图得一直线,其图形如图6所示。
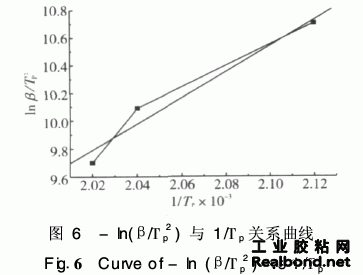
由图6可知斜率为9·32,由Kissinger式求得 表观活化能:E=9·32×103×8·31441=77·5 kJ mol。此值与Ozawa方法求得的表观活化能81·56 kJ/mol相近似。取其平均值79·53 kJ/mol作为最 终值。
反应级数n可由Crane方程求出, Crane[8]方 程见式3。
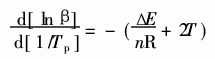
式中,β-等速升温速度(℃/min);Tp-峰 顶温度(K); R-理想气体常数8·3145 J/(mol· K);△E-表观活化能J/mo;ln-反应级数。 根据DSC结果,求得lnβ及1/Tp的值,以ln β对1/Tp作图,图形如图5。求得其斜率为-10·32。 根据Crane方程,计算得n=0·95。
