2 结果与讨论
2·1 反应条件对结果的影响
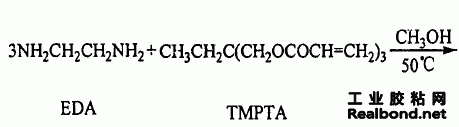
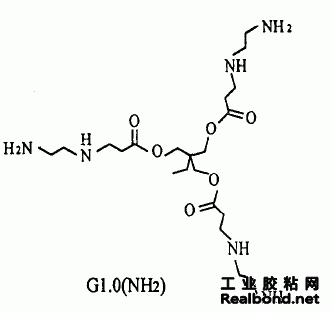
G1·0(NH2)的合成原理如下页所示。
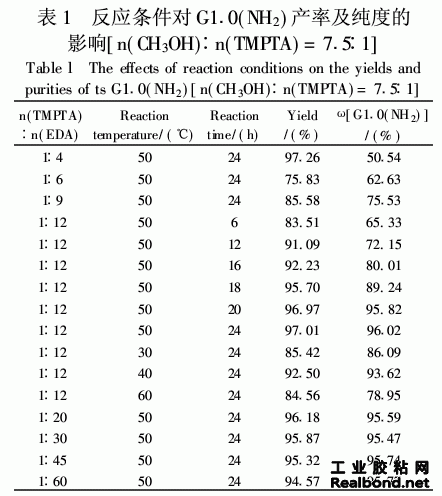
2·2·1 原料配比 TMPTA端基有三个丙烯酸酯 双键,故TMPTA与EDA的化学计量关系为1∶3。 从表1可以看出,当n(TMPTA)∶n(EDA)为1∶4 时,产率最高,但G1·0(NH2)含量最低,这是因为体系中TMPTA的含量相对较多,目标产物端基的 伯胺基可能与残余TMPTA或副产物中的双键进 一步发生反应。当n(TMPTA)∶n(EDA)从1∶6到1 ∶12时,产物的产率和纯度都呈上升趋势。当n (TMPTA)∶n(EDA)从1∶20到1∶60时,产率和纯度 基本不变。所以将1∶12作为TMPTA与EDA反应 的合适摩尔比。
2·1·2 反应温度和反应时间
在一定的原料摩尔比以及反应时间下,随着反应温度的升高,产物的产率与纯度都呈上升趋势。但继续升温,纯度会下降,因为酰胺化副反应逐渐加剧,所以将50℃作为合适的反应温度。反应时间从6h到 20h,产物的产率和纯度都明显上升,继续延长至 24h,产物的产率和纯度基本不变,从而可以得出, 合适的反应时间为24h。
2·2 G1·0(NH2)的结构表征
G1·0(NH2)的红外光谱图(图略)显示产物含 有NH2(3294·7 cm-1, C=O(1647·3 cm-1), C-N(1373·4,1118·8 cm-1),而且3294·7cm-1处NH2的 吸收又宽又强,是多个NH2存在的表现。
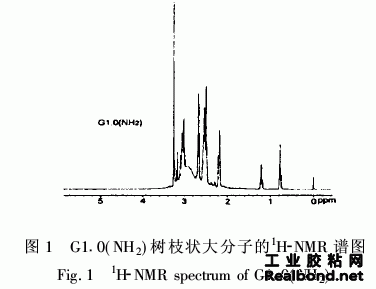
由图1G1·0(NH2)的1H-NMR谱图知所得产物 结构中含有CH3(0·794,0·775,0·756);CH3*CH2 (1·236, 1·217, 1·197, 1·182); CH2COO (2·525, 2·502,2·479);*CH2NH2(2·514-2·572);NH*CH2 CH2NH2(2·679, 2·694, 2·725);*CH2NH(3·005, 3·021, 3·036); CH2OCO (3·259),包含了G1·0 (NH2)结构中所有与碳原子相连的氢质子。
元素分析结果C(52·26)52·94,H(10·08)9·24,N (18·24)17·65说明所合成的产物是G1·0(NH2)。 2·3 不同体系的适用期、凝胶时间和等温固化时间 G1·0(NH2)挥发性小,毒性小,很容易与环氧 树脂混匀,G1·0(NH2)和EDA均用按下式计算的 理论量:G=M/N,其中G为100 g环氧树脂需要 加入固化剂的理论量(g);M为固化剂分子量;N 为固化剂分子中氮原子上活泼氢的数目。含不同 固化剂的环氧树脂体系的适用期、凝胶时间和固 化时间列于表2,由表可见,G1·0(NH2)作为固化 剂的体系适用期和凝胶时间分别是EDA作为固 化剂的体系的4·0倍和1·6倍,而在50、95、120和 150℃固化时,前一体系的固化速度分别是后一体 系的1·4、2·6、4·5、6·0倍。这可能是由于G1·0 (NH2)分子体积庞大,运动不如EDA分子自如,因 此较低温度时其所在体系的适用期、凝胶时间都比较长,但温度升高时,分子运动加快,树枝状大 分子有多个活泼氢,且这些活泼氢都在大分子外 围,所以固化反应速度大大加快。说明G1·0 (NH2)作为固化剂的体系在低温有较长的可使用时间,能方便操作和施工,但在较高的温度下又能 很快固化,提高工作效率。
